Szczepionka na koronawirusa. "Pierwsi Amerykanie mogą ją otrzymać w grudniu"
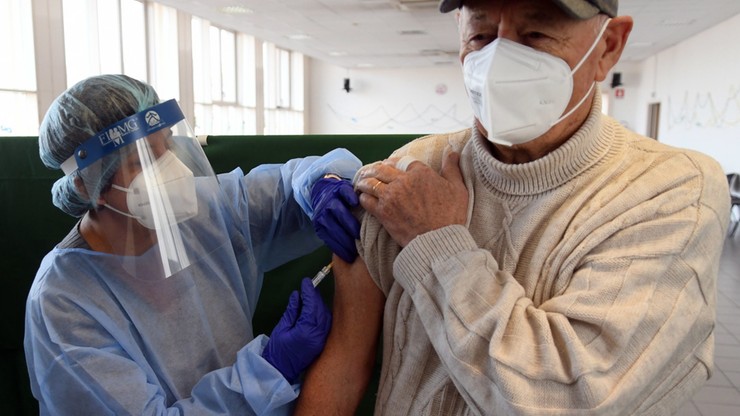
Pierwsi Amerykanie mogą otrzymać szczepionki na koronawirusa już 11 grudnia - poinformował w rozmowie z CNN szef amerykańskiego programu szczepień na Covid-19 dr Moncef Slaoui.
- Naszym planem jest umożliwienie wysyłania szczepionek do ośrodków szczepień w ciągu 24 godzin od ich zatwierdzenia, więc spodziewam się, że (pierwsze osoby mogą być zaszczepione - red.) kolejnego dnia po zatwierdzeniu, czyli 11 lub 12 grudnia - powiedział Slaoui.
ZOBACZ: Na imprezie skończył się alkohol, wypili środek dezynfekujący. Nie żyje siedem osób
Dodał, że spodziewa się, że dzieci otrzymają szczepionki w połowie przyszłego roku. Wyjaśnił, że najmłodsze osoby, które dotąd zostały zaszczepione w ramach testów Pfizera, miały 12-14 lat. - Nie wiem, czy FDA zatwierdzi szczepionki do użycia dla tak niskiego wieku. Może zatrzymają się na 18 latach i więcej - powiedział.
Pfizer wystąpił w piątek do władz USA o zezwolenie na dopuszczenie do użytku w trybie nadzwyczajnym swojej szczepionki przeciw koronawirusowi. Agencja ds. Żywności i Leków (FDA) ma się w tej sprawie spotkać 10 grudnia.
Zatwierdzony lek
Amerykańska Agencja ds. Żywności i Leków (FDA) zezwoliła na użycie w nagłych wypadkach leku firmy Regeneron, który w październiku podano choremu na Covid-19 prezydentowi USA Donaldowi Trumpowi.
FDA w sobotę zezwoliła na podanie eksperymentalnej mieszanki przeciwciał firmy Regeneron, aby zapobiec hospitalizacji i nasileniu się choroby u pacjentów z łagodnymi i umiarkowanymi objawami Covid-19.
Lek podaje się jednorazowo, dożylnie. FDA zezwoliła na jego stosowanie u dorosłych i dzieci w wieku powyżej 12 lat, ważących co najmniej 40 kg i narażonych na ciężki przebieg Covid-19 ze względu na wiek lub inne choroby.
Dawki dla ok. 300 tys. pacjentów
Zezwolenie w trybie pilnym umożliwia rozpoczęcie stosowania leku, podczas gdy trwają badania dotyczące jego bezpieczeństwa i skuteczności stosowania.
Regeneron poinformował, że początkowo udostępni dawki dla ok. 300 tys. pacjentów. Nie będą oni obciążeni kosztami leku.
W październiku FDA zatwierdziła remdesivir firmy Gilead Sciences jako lek na koronawirusa. W maju wydała zezwolenie na stosowanie leku w nagłych wypadkach, umożliwiając szpitalom i lekarzom stosowanie go u pacjentów hospitalizowanych z powodu Covid-19. Remdisivir także był stosowany w leczeniu prezydenta Trumpa.
Czytaj więcej